Morfogenees
Morfogenees (kreeka morphê "kuju" ja genesis "loomine", sõna-sõnalt „vormi tekkimine“) on ontogeneesis toimuv bioloogiline protsess, mille tulemusena rakk, kude või organism omandab oma kuju. See on üks kolmest arengubioloogia põhiaspektist koos kudede kasvu ja rakkude diferentseerumisega.
Protsess kontrollib rakkude organiseeritud ruumilist jaotumist organismi embrüonaalse arengu ajal. Morfogenees võib toimuda ka küpses organismis, näiteks kudede normaalsel säilitamisel tüvirakkude poolt või kudede regenereerimisel pärast kahjustusi. Vähk on näide äärmiselt ebanormaalsest ja patoloogilisest koe morfogeneesist. Morfogenees kirjeldab ka selliste ainuraksete eluvormide arengut, mille elutsüklis ei ole embrüonaalset staadiumi. Morfogenees on oluline uute vormide evolutsiooniks.
Morfogenees on mehaaniline protsess, mis hõlmab jõudusid, mis tekitavad mehaanilist pinget, tüve ja rakkude liikumist[1] ning mida saab esile kutsuda geneetiliste programmide abil vastavalt rakkude ruumilisele mustrile kudedes. Ebanormaalset morfogeneesi nimetatakse düsmorfogeneesiks.
Ajalugu
[muuda | muuda lähteteksti]Mõned esimesed ideed ja matemaatilised kirjeldused selle kohta, kuidas füüsikalised protsessid ja piirangud mõjutavad bioloogilist kasvu ja seega ka looduslikke mustreid, nagu näiteks leheseisu spiraalid, on kirjeldatud D'Arcy Wentworth Thompsoni 1917. aasta raamatus „On Growth and Form“[2][3] ja Alan Turingi teoses „The Chemical Basis of Morphogenesis“ (1952).[4] Seal, kus Thompson seletas loomade kehakujude tekkimist erineva kasvukiirusega eri suundades, näiteks tigude spiraalse kesta loomiseks, ennustas Turing õigesti morfogeneesi mehhanismi, kahe erineva keemilise signaali, millest üks aktiveerib ja teine deaktiveerib kasvu, levikut, et luua arengumustreid, aastakümneid enne, kui selliste mustrite teket täheldati.[5] Tegelike organismide mehhanismide täielikuks mõistmiseks oli vaja DNA struktuuri avastamist 1953. aastal ning molekulaarbioloogia ja biokeemia arengut.
Geneetiline ja molekulaarne alus
[muuda | muuda lähteteksti]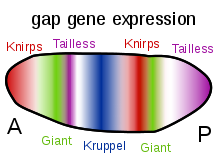
Morfogeneesis on olulised mitut tüüpi molekulid. Morfogeenid on lahustuvad molekulid, mis võivad hajuda ja edastada signaale, mis kontrollivad rakkude diferentseerumist kontsentratsioonigradiendi kaudu. Morfogeenid toimivad tavaliselt seondumise kaudu spetsiifiliste valgu retseptoritega. Oluline molekulide klass, mis on seotud morfogeneesiga, on transkriptsioonifaktorite valgud, mis määravad rakkude käitumise, toimides koos DNAga. Need võivad olla kodeeritud peamiste regulatiivsete geenide poolt ja kas aktiveerida või deaktiveerida teiste geenide transkriptsiooni; need sekundaarsed geeniproduktid võivad omakorda reguleerida veel teiste geenide ekspressiooni geeniregulatsioonivõrgustike regulatiivses kaskaadis. Selle kaskaadi lõpus on molekulide klassid, mis kontrollivad rakkude käitumist, näiteks rakkude migratsiooni, või üldisemalt nende omadusi, näiteks raku adhesiivsust või raku kontraktiilsust. Näiteks gastrulatsiooni ajal lülitavad tüvirakkude kogumid oma rakkude vahelise adhesiivsuse välja, muutuvad rändavaks ja võtavad embrüo sees uue positsiooni, kus nad taas aktiveerivad spetsiifilisi rakkude adhesioonivalke ja moodustavad uusi kudesid ja organeid. Morfogeneesisse kaasatud arengut soodustavad signaaliradade hulka kuuluvad Wnt ja Hedgehogi signaalirajad ning efriinid (ingl Ephrins).[6]
Rakuline alus
[muuda | muuda lähteteksti]
Koetasandil, jättes tähelepanuta kontrollivahendid, tekib morfogenees rakkude paljunemise ja liikuvuse tõttu[7]. Morfogenees hõlmab ka muutusi raku struktuuris[8] või seda, kuidas rakud kudedes omavahel suhtlevad. Nende muutuste tulemuseks võib olla kudede pikenemine, hõrenemine, voldimine, invasioon või ühe koe eraldumine erinevateks kihtideks. Viimast juhtumit nimetatakse sageli rakkude sorteerimiseks. Rakkude „välja sorteerumine“ seisneb rakkude liikumises nii, et need sorteeruvad klastritesse, mis maksimeerivad kontakti sama tüüpi rakkude vahel. Rakkude võimet seda teha on Malcolm Steinberg oma diferentseeritud adhesiohüpoteesi kaudu väitnud, et see tuleneb rakkude diferentseeritud adhesiivsusest. Kudede eraldumine võib toimuda ka järsemate rakkude diferentseerumise sündmuste kaudu, mille käigus epiteelirakud muutuvad mesenhüümiliseks (vt Epiteel-mesenhüüm-üleminek). Mesenhüümilised rakud lahkuvad tavaliselt epiteelkoest rakkude adhesiivsete ja kontraktiilsete omaduste muutumise tagajärjel. Pärast epiteel-mesenhüüm üleminekut võivad rakud epiteelist ära rännata ja seejärel assotsieeruda teiste sarnaste rakkudega uues asukohas.[9] Taimedes on rakkude morfogenees tihedalt seotud rakuseina keemilise koostise ja mehaaniliste omadustega[10][11].
Rakkude vaheline adhesiivsus
[muuda | muuda lähteteksti]Embrüonaalse arengu ajal piirduvad rakud eri kihtide vaheliste erinevuste tõttu. Üks võimalus, kuidas see võib toimuda, on see, kui rakud jagavad samu rakkudevahelisi adhesioonimolekule. Näiteks võib homotüüpne rakkude adhesiivsus säilitada piirid rakurühmade vahel, millel on erinevad adhesiivsed molekulid. Peale selle võivad rakud sorteeruda rakkude vahelise adhesiivsuse erinevuste alusel, nii et isegi kaks rakukultuuri, millel on sama adhesiivmolekuli erinev tase, võivad sorteeruda. Rakukultuuris liiguvad kõige tugevama adhesiooniga rakud segunenud rakuagregaatide keskele. Lisaks sellele moduleerib rakkudevahelist adhesiivsust sageli rakkude kontraktsioon, mis või rakkudevahelistele kontaktidele jõudu avaldada, nii et kaks rakukultuuri, millel on sama adhesiivmolekuli võrdne tase, võivad üksteisest eralduda. Adhesiivsuse eest vastutavaid molekule nimetatakse raku adhesioonimolekuliteks (lüh ingl CAM). On teada mitmeid raku adhesioonimolekulide tüüpe ja üks peamisi nende molekulide klass on kadheriinid (ingl Cadherin). On olemas kümneid erinevaid kadheriine, mis ekspresseeruvad erinevatel rakutüüpidel. Kadheriinid seonduvad teiste kadheriinidega sarnaselt: E-kadheriin[12] (mida leidub paljudel epiteelirakkudel) seondub eelistatult teiste E-kadheriini molekulidega. Mesenhüümilised rakud ekspresseerivad tavaliselt teisi kadheriini tüüpe, näiteks N-kadheriini.[13][14]
Ekstratsellulaarne maatriks
[muuda | muuda lähteteksti]Ekstratsellulaarne maatriks (lüh ingl ECM) on seotud kudede eraldatuse säilitamisega, struktuurilise toe andmisega või rakkude rändamise struktuuri pakkumisega. Kollageen, laminiin ja fibronektiin on peamised ECM-molekulid, mis erituvad ja koonduvad lehtedeks, kiududeks ja geelideks. ECM-iga seondumiseks kasutatakse mitmeliigilisi transmembraaniretseptoreid, mida nimetatakse integriinideks[15]. Integriinid seonduvad ekstratsellulaarselt fibronektiini, laminiini või muude ECM komponentidega ja intratsellulaarselt mikrofilamentide sidumise valkudega α-aktiniin ja taliin, et siduda tsütoskelett väliskeskkonnaga. Integriinid toimivad ka retseptoritena, mis käivitavad ECM-iga seondudes signaalitransduktsioonikaskadeid. Hästi uuritud näide morfogeneesi kohta, mis hõlmab ECM-i, on rinnanäärme kanalite hargnemine[16][17].
Raku kontraktiilsus
[muuda | muuda lähteteksti]Koed võivad muuta oma kuju ja eralduda erinevateks kihtideks rakkude kontraktiilsuse kaudu. Nii nagu lihasrakkudes, võib müosiin tõmbuda kokku tsütoplasma eri osi, et muuta selle kuju või struktuuri. Müosiinist tingitud kontraktiilsust embrüonaalses koemorfogeneesis on täheldatud lootelehe eraldumisel mudelorganismides Caenorhabditis elegans, Drosophila ja sebrakala. Embrüonaalses morfogeneesis esineb sageli perioodilisi kontraktsiooni impulsse. Mudel, mida nimetatakse raku seisundi jagajaks (ingl the cell state splitter), hõlmab vahelduvat raku kokkutõmbumist ja laienemist, mida algatab iga raku apikaalses otsas asuv bistabiilne organell. Organell koosneb mikrotuubulitest ja mikrofilamentidest, mis on mehaaniliselt vastandunud. See reageerib morfogeneetilistest liikumistest põhjustatud lokaalsetele mehaanilistele häiretele. Need vallandavad seejärel embrüonaalse diferentseerumise rändlaineid, mille käigus toimub kontraktsioon või ekspansioon üle eeldatavate kudede, mis määravad rakutüübi ja millele järgneb rakkude diferentseerumine. Raku seisundi jagunemist pakuti esmakordselt välja seletamaks neuraalplaadi morfogeneesi aksolotli gastrulatsiooni ajal[18] ja hiljem üldistati see mudel kogu morfogeneesile[19][20].
Hargnemismorfogenees
[muuda | muuda lähteteksti]Kopsu arengus hargneb bronhis bronhioolideks, mis moodustavad hingamisteede "puu".[21] Hargnemine on tingitud iga bronhiooltoru otsa hargnemisest ja hargnemismorfogeneesi käigus moodustuvad bronhid, bronhioolid ja lõpuks alveoolid[22].
Hargnenud morfogenees ilmneb ka rinnanäärme kanalite moodustumisel.[16][17] Primitiivne kanalite moodustumine algab arengus, kuid kanalite süsteemi hargnemine algab hiljem vastuseks östrogeenile puberteedi ajal ja täiustub edasi vastavalt rinnanäärme arengule.[17][23][24].
Vähi morfogenees
[muuda | muuda lähteteksti]Vähk võib tuleneda normaalse morfogeneesi häiretest, sealhulgas nii kasvaja moodustumisest kui ka kasvaja metastaasist. Mitokondriide düsfunktsioon võib põhjustada vähiriski suurenemist häiritud morfogeensignalisatsiooni tõttu.[25]
Viiruse morfogenees
[muuda | muuda lähteteksti]Bakteriofaagi (faag) T4 viiruse kokkupaneku ajal interakteeruvad faagigeenide poolt kodeeritud morfogeneetilised valgud üksteisega iseloomulikus järjestuses. Iga sellise valgu koguse sobiva tasakaalu säilitamine viirusnakkuse ajal toodetud valkude vahel näib olevat kriitilise tähtsusega normaalse faag T4 morfogeneesi jaoks.[26] Faag T4 kodeeritud valgud, mis määravad viiruse struktuuri, hõlmavad peamisi struktuurikomponente, vähemtähtsaid struktuurikomponente ja mittestruktuurilisi valke, mis katalüüsivad konkreetseid etappe morfogeneesi järjestuses.[27] Faag T4 morfogenees jaguneb kolmeks sõltumatuks teeks: pea, saba ja pikad sabakiud, nagu Yap ja Rossman kirjeldavad üksikasjalikult.[28]
Arvutimudelid
[muuda | muuda lähteteksti]Lähenemine morfogeneesi modelleerimiseks arvutiteaduses või matemaatikas võib olla seotud Alan Turingi 1952. aasta kirjatööga „The chemical basis of morphogenesis“[29], mudel, mida nüüd tuntakse Turingi mustrina.
Teine kuulus mudel on nn “Prantsuse lipu mudel (ing k French flag model)”, mis töötati välja 1960. aastatel.[30]
Arvutite jõudluse paranemine 21. sajandil võimaldas suhteliselt keeruliste morfogeneesi mudelite simuleerimist. 2020. aastal pakuti välja selline mudel, kus rakkude kasv ja diferentseerumine on parameetriseeritud reeglitega rakuautomaat. Kuna reeglite parameetrid on diferentseeritavad, saab neid treenida gradientse laskumisega, mis on viimastel aastatel[millal?] tänu masinõppes kasutamisele väga optimeeritud tehnika.[31] See mudel piirdus piltide genereerimisega ja on seega kahemõõtmeline.
Eespool kirjeldatuga sarnast mudelit laiendati hiljem kolmemõõtmeliste struktuuride genereerimiseks ja seda demonstreeriti videomängus Minecraft, mille plokipõhine olemus tegi selle eriti otstarbekaks 3D rakuautomaatide simulatsiooniks.[32]
Vaata ka
[muuda | muuda lähteteksti]- Diferentseerumine
- Fotomorfogenees
- Embrüogenees
- Neurulatsioon
- Gastrulatsioon
- Alan Turing
- Turingi muster
Viited
[muuda | muuda lähteteksti]- ↑ Bidhendi, Amir J.; Altartouri, Bara; Gosselin, Frédérick P.; Geitmann, Anja (July 2019). "Mechanical stress initiates and sustains the morphogenesis of wavy leaf epidermal cells". Cell Reports. 28 (5): 1237–1250. doi:10.1016/j.celrep.2019.07.006. PMID 31365867.
- ↑ Thompson, D'Arcy Wentworth (1917). On Growth and Form. Cambridge University Press.
- ↑ Montell, Denise J. (5 December 2008), "Morphogenetic Cell Movements: Diversity from Modular Mechanical Properties" (PDF), Science, 322 (5907): 1502–1505, Bibcode:2008Sci...322.1502M, doi:10.1126/science.1164073, PMID 19056976, archived from the original (PDF) on 28 November 2014, retrieved 11 December 2012
- ↑ Turing, A. M. (1952). "The Chemical Basis of Morphogenesis". Philosophical Transactions of the Royal Society B. 237 (641): 37–72. Bibcode:1952RSPTB.237...37T. doi:10.1098/rstb.1952.0012.
- ↑ Hiscock, Tom W.; Megason, Sean G. (2015). "Orientation of Turing-like Patterns by Morphogen Gradients and Tissue Anisotropies". Cell Systems. 1 (6): 408–416. doi:10.1016/j.cels.2015.12.001. PMID 26771020.
- ↑ Kouros-Mehr, H.; Werb, Z. (2006). "Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis". Dev. Dyn. 235 (12): 3404–12. doi:10.1002/dvdy.20978. PMID 17039550.
- ↑ Montévil, Maël; Speroni, Lucia; Sonnenschein, Carlos; Soto, Ana M. (2016). "Modeling mammary organogenesis from biological first principles: Cells and their physical constraints". Progress in Biophysics and Molecular Biology. From the Century of the Genome to the Century of the Organism: New Theoretical Approaches. 122 (1): 58–69. arXiv:1702.03337. doi:10.1016/j.pbiomolbio.2016.08.004. PMID 27544910.
- ↑ Duran-Nebreda, Salva; Pla, Jordi; Vidiella, Blai; Piñero, Jordi; Conde-Pueyo, Nuria; Solé, Ricard (2021-01-15). "Synthetic Lateral Inhibition in Periodic Pattern Forming Microbial Colonies". ACS Synthetic Biology. 10 (2): 277–285. doi:10.1021/acssynbio.0c00318. ISSN 2161-5063. PMID 33449631.
- ↑ Gilbert, Scott F. (2000). "Morphogenesis and Cell Adhesion". Developmental biology (6th ed.). Sunderland, Mass: Sinauer Associates. ISBN 978-0-87893-243-6.
- ↑ Bidhendi, Amir J; Geitmann, Anja (January 2016). "Relating the mechanical properties of the primary plant cell wall to morphogenesis" (PDF). Journal of Experimental Botany. 67 (2): 449–461. doi:10.1093/jxb/erv535. PMID 26689854.
- ↑ Bidhendi, Amir J; Geitmann, Anja (January 2018). "Finite element modeling of shape changes in plant cells". Plant Physiology. 176 (1): 41–56. doi:10.1104/pp.17.01684. PMID 29229695.
- ↑ Semb H, Christofori G (December 1998). "The tumor-suppressor function of E-cadherin". American Journal of Human Genetics. 63 (6): 1588–93. doi:10.1086/302173. PMC 1377629. PMID 9837810.
- ↑ Hulpiau, P.; van Roy, F. (February 2009). "Molecular evolution of the cadherin superfamily". Int. J. Biochem. Cell Biol. 41 (2): 349–69. doi:10.1016/j.biocel.2008.09.027. PMID 18848899.
- ↑ Angst, B.; Marcozzi, C.; Magee, A. (February 2001). "The cadherin superfamily: diversity in form and function". J Cell Sci. 114 (Pt 4): 629–41. doi:10.1242/jcs.114.4.629. PMID 11171368.
- ↑ Hynes RO (September 2002). "Integrins: bidirectional, allosteric signaling machines". Cell. 110 (6): 673–87. doi:10.1016/s0092-8674(02)00971-6.
- ↑ 16,0 16,1 Fata JE, Werb Z, Bissell MJ (2004). "Regulation of mammary gland branching morphogenesis by the extracellular matrix and its remodeling enzymes". Breast Cancer Res. 6 (1): 1–11. doi:10.1186/bcr634. PMC 314442. PMID 14680479.
- ↑ 17,0 17,1 17,2 Sternlicht MD (2006). "Key stages in mammary gland development: the cues that regulate ductal branching morphogenesis". Breast Cancer Res. 8 (1): 201. doi:10.1186/bcr1368. PMC 1413974. PMID 16524451.
- ↑ Gordon, Richard; Brodland, G. Wayne (1987). "The cytoskeletal mechanics of brain morphogenesis". Cell Biophysics. 11: 177–238. doi:10.1007/BF02797122. PMID 2450659. S2CID 4349055.
- ↑ Gordon, Natalie K.; Gordon, Richard (2016). "The organelle of differentiation in embryos: The cell state splitter". Theoretical Biology and Medical Modelling. 13: 11. doi:10.1186/s12976-016-0037-2. PMC 4785624. PMID 26965444.
- ↑ Gordon, Natalie K.; Gordon, Richard (2016). Embryogenesis Explained. doi:10.1142/8152. ISBN 978-981-4350-48-8.
- ↑ Wolpert, Lewis (2015). Principles of development (5th ed.). Oxford University Press. pp. 499–500. ISBN 978-0-19-967814-3.
- ↑ Miura, T (2008). "Modeling Lung Branching Morphogenesis". Multiscale Modeling of Developmental Systems. Current Topics in Developmental Biology. Vol. 81. pp. 291–310. doi:10.1016/S0070-2153(07)81010-6. ISBN 9780123742537. PMID 18023732.
- ↑ Hynes, N. E.; Watson, C. J. (2010). "Mammary Gland Growth Factors: Roles in Normal Development and in Cancer". Cold Spring Harbor Perspectives in Biology. 2 (8): a003186. doi:10.1101/cshperspect.a003186. ISSN 1943-0264. PMC 2908768. PMID 20554705.
- ↑ Jay R. Harris; Marc E. Lippman; C. Kent Osborne; Monica Morrow (28 March 2012). Diseases of the Breast. Lippincott Williams & Wilkins. pp. 94–. ISBN 978-1-4511-4870-1.
- ↑ Fosslien E (2008). "Cancer morphogenesis: role of mitochondrial failure" (PDF). Annals of Clinical & Laboratory Science. 38 (4): 307–329. PMID 18988924. S2CID 4538888. Archived from the original (PDF) on 2017-09-21.
- ↑ Floor, Erik (1970). "Interaction of morphogenetic genes of bacteriophage T4". Journal of Molecular Biology. 47 (3): 293–306. doi:10.1016/0022-2836(70)90303-7. PMID 4907266.
- ↑ Snustad, D.Peter (1968). "Dominance interactions in Escherichia coli cells mixedly infected with bacteriophage T4D wild-type and amber mutants and their possible implications as to type of gene-product function: Catalytic vs. Stoichiometric". Virology. 35 (4): 550–563. doi:10.1016/0042-6822(68)90285-7. PMID 4878023.
- ↑ Yap, Moh Lan; Rossmann, Michael G. (2014). "Structure and function of bacteriophage T4". Future Microbiology. 9 (12): 1319–1327. doi:10.2217/fmb.14.91. PMC 4275845. PMID 25517898.
- ↑ Turing, Alan Mathison (1952). "The chemical basis of morphogenesis". Philosophical Transactions of the Royal Society B. 237 (641): 37–72. Bibcode:1952RSPTB.237...37T. doi:10.1098/rstb.1952.0012. S2CID 937133.
- ↑ Sharpe, James; Green, Jeremy (2015). "Positional information and reaction-diffusion: two big ideas in developmental biology combine". Development. 142 (7): 1203–1211. doi:10.1242/dev.114991. hdl:10230/25028. PMID 25804733.
- ↑ Mordvintsev, Alexander; Randazzo, Ettore; Niklasson, Eyvind; Levin, Michael (2020). "Growing Neural Cellular Automata". Distill. 5 (2). doi:10.23915/distill.00023. S2CID 213719058.
- ↑ Sudhakaran, Shyam; Grbic, Djordje; Li, Siyan; Katona, Adam; Najarro, Elias; Glanois, Claire; Risi, Sebastian (2021). "Growing 3D Artefacts and Functional Machines with Neural Cellular Automata". arXiv:2103.08737 [cs.LG].
